Der Ursprung des Lebens
Das Miller Experiment - Teil 2
Autorin: Sabine Himmelein Februar 2003
![]() 4.4 Versuchsergebnisse und Auswertung
4.4 Versuchsergebnisse und Auswertung
![]() 4.4.1 Der Reaktionsmechanismus zur Synthese der Aminosäuren
4.4.1 Der Reaktionsmechanismus zur Synthese der Aminosäuren
![]() 4.4.2 Die späteren Versuchsergebnisse
4.4.2 Die späteren Versuchsergebnisse
![]() 4.5 Die wichtigsten Erkenntnisse aus Folgeexperimenten
4.5 Die wichtigsten Erkenntnisse aus Folgeexperimenten
![]() 5. Die Schwachpunkte und Kritik am Miller-Urey-Experiment
5. Die Schwachpunkte und Kritik am Miller-Urey-Experiment
![]() 6. Die Bedeutung und Würdigung der Arbeit von Miller
6. Die Bedeutung und Würdigung der Arbeit von Miller
![]() 7. Versuche zur Synthese von Aminosäuren nach dem Vorbild des Miller-Experiments
7. Versuche zur Synthese von Aminosäuren nach dem Vorbild des Miller-Experiments
![]() 7.1 Der Versuchsaufbau
7.1 Der Versuchsaufbau
![]() 7.2 Der erste Versuchslauf
7.2 Der erste Versuchslauf
| 4.4 Versuchsergebnisse und Auswertung |
Nach einer Woche stoppte Miller den Versuch, pumpte die Gase ab und entnahm die Lösung, welche sich im kleinen Kolben und U-Rohr angesammelt hatte. Ihre rote Farbe wurde auf entstandene organische Verbindungen zurückgeführt. Zunächst untersuchte Miller die in der Lösung synthetisierten Produkte mit Hilfe der Papierchromatographie in zweidimensionaler Auftrennung. Das Chromatogramm wurde erst von n-Butanol-Essigsäure-Wasser und im zweiten Schritt senkrecht dazu von Phenol durchflossen. Nach Trocknen der Chromatographieplatte besprühte Miller diese mit Ninhydrin, das mit Aminosäuren zu einem violetten Farbstoff reagiert. Das Chromatogramm ergab folgerndes Bild:
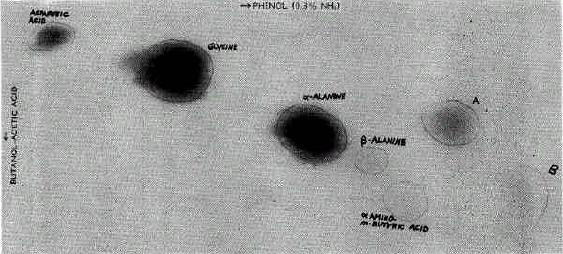
Man kann deutlich die Flecken der getrennten Substanzen erkennen, bei denen es sich um einfache
Aminosäuren handelt. Die Identifikation der Aminosäuren erfolgte durch ein
Vergleichschromatogramm mit bekannten Aminosäuren. Über den Vergleich von Rf-Wert, Form und
Farbe der erhaltenen Flecke konnte Miller die Aminosäuren Glycin, alpha-Alanin und beta-Alanin
ausmachen. Die Substanzflecke der Asparaginsäure und alpha-Amino-n-Buttersäure fallen
schwächer aus. Die mit A und B markierten Substanzen konnte Miller zunächst nicht identifizieren,
er vermutete aber, dass es sich um beta- und gamma-Aminosäuren handelte. Außerdem nahm er
an, dass noch andere Aminosäuren in kleinern Mengen synthetisiert wurden. Insgesamt seien
einige Milligramm an Aminosäuren entstanden.12
Dies entsprach einer unerwartet großen Menge,
wenn man bedenkt, dass die Synthesebedingungen nicht spezifisch zur Herstellung von
Aminosäuren, sondern nach den Bedingungen der frühen Erde gewählt wurden.
Von der entstanden gelb-braunen Verbindungen lies sich nur ein kleinerer Bruchteil mit Ether
auslösen. Dieses Syntheseprodukt bildete einen durchgängigen, sich verlaufenden Streifen bei der
eindimensionalen chromatographische Auftrennung in Butanol-Essigsäure und sollte erst später
näher analysiert werden.
Nach der Veröffentlichung der Versuchsergebnisse13 verfeinerte Miller das Experiment und seine Analysemethoden. Mit Hilfe von Siedepunktbestimmungen konnte er die ersten Ergebnisse bestätigen und fand heraus, dass neben Glycin und Alanin auch Spuren von Glutaminsäure, Asparaginsäure, Valin, Leucin, Serin, Prolin und Threonin, also insgesamt neun verschiedene proteinogene Aminosäuren synthetisiert wurden. Um eine Verunreinigung durch Bakterien auszuschließen sterilisierte Miller die Apparatur gründlichst und wiederholte das Experiment mit gleichem Erfolg.14 Eine Auflistung aller nachgewiesenen Verbindungen ist in der folgenden Tabelle wiedergegeben.
| Entstandene Verbindung | Anteil |
| Teer | 85% |
| Carbonsäuren | 13,00% |
| Glycin | 1,05% |
| Alanin | 0,85% |
| Glutaminsäure | Spuren |
| Asparaginsäure | Spuren |
| Valin | Spuren |
| Leucin | Spuren |
| Serin | Spuren |
| Prolin | Spuren |
| Threonin | Spuren |
| Tab.1: quantitative Auflistung der Produkte | |
12 vgl. [1]
13 siehe [1]
14 vgl. [3], S.48, [9]
| 4.4.1 Der Reaktionsmechanismus zur Synthese der Aminosäuren |
Miller konnte außerdem den Reaktionsmechanismus aufklären, der bei seinem Experiment zum Entstehen der meisten Aminosäuren geführt hat. Bei der Analyse der erhaltenen Lösung fand er neben Aminosäuren auch große Mengen an Aldehyden, Ketonen und Blausäure. Diese wurden aus Radikalen und Ionen, die durch die elektrische Entladung entstanden waren, gebildet und konnten mit Wasser nach der Strecker-Synthese zu Aminosäuren reagieren. Dabei wird zunächst Ammoniak an ein Aldehyd addiert. Nach der Abspaltung eines Wassermoleküls entsteht ein Imin.
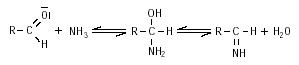
Im zweiten Schritt addiert sich Cyanwasserstoff an das Imin und ergibt ein Aminonitril.
![]()
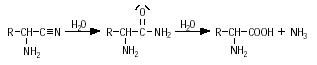
| 4.4.2 Die späteren Versuchsergebnisse |
In den 70er und 90er Jahren wiederholte Dr. Miller, der inzwischen Professor an der Universität von San Diego war, mit Hilfe seiner Mitarbeiter das Experiment und konnte genauere Ergebnisse durch bessere analytische Methoden erzielen. Hierbei wurden fast alle 20 Aminosäuren gefunden, die Proteine aufbauen können und somit von biologischer Bedeutung sind. Neben den Aminosäuren entstanden auch Harnstoff und wichtige Hydroxycarbonsäuren, die gemäß der Strecker-Synthese durch die Addition von Blausäure an Aldehyd und anschließender Hydrolysierung gebildet wurden.
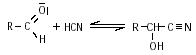
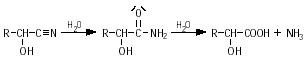
Außer Glycolsäure, Milchsäure und Propionsäure wurden noch weitere
Hydroxycarbonsäuren entsprechend der ihnen verwandten,
synthetisierten Aminosäuren nachgewiesen.16
Den größten Anteil der Syntheseprodukte bildete aber weiterhin die ölig
bis teerige und klebrige "Schmiere"17, die sich auf der Innenseite des
großen Kolbens angesammelt hatte (vgl. Abb.9). Die wasserlöslichen Komponenten dieser Substanz färbten Wasser tiefbraun und gaben
Adenin frei. Der größte Teil war jedoch wasserunlöslich. Nach chemischer Behandlung gab aber auch dieses Material Aminosäuren frei.

Es stellte sich heraus, dass es sich um ein sehr beständiges und komplexes Netzwerk aus organischen Verbindungen handelt. Dieser Stoff könnte aus diversen Gründen eine wichtige Rolle bei der Entstehung von Leben
gespielt haben. Beispielsweise als stetiger Aminosäurelieferant, als Schutz der entstandenen Verbindungen vor der Zerstörung durch UV-Strahlung18 oder auch bei der Ausbildung von Zellwänden, da einige der in ihm enthaltenen Moleküle fettähnliche Eigenschaften besitzen.19
16 vgl. [2], S. 88
17 vgl. [3], S.49
18 vgl. [14]
19 vgl. [3], S.49 u. 95-96
| 4.5 Die wichtigsten Erkenntnisse aus Folgeexperimenten |
Ausgehend von Millers erstem Simulationsexperiment zur frühen Erde führten auch andere Wissenschaftler Urgasversuche unter verschiedensten atmosphärischen Bedingungen und mit unterschiedlichen Energiequellen durch. Dabei konnten eine Vielzahl weiterer organischer Verbindungen hergestellt werden, die für den Stoffwechsel lebender Organismen von Bedeutung sind. Man synthetisierte inzwischen alle 20 proteinogenen Aminosäuren, diverse Zucker, Lipide, die Bausteine der Nukleinsäuren Purine, Pyrimidine und Nukleotide , Porphyrine, die z.B. im Chlorophyll enthalten sind, sowie (bei Anwesenheit von Phosphat) sogar ATP. Es stellte sich heraus, dass auch andere Energien, wie UV-Strahlung, ionisierende Strahlung, Wärme oder Schockwellen zu den gleichen Produkten führen, wobei die Ausbeute an Aminosäuren unter dem Einfluss elektrischer Entladungen am größten ist. Ohne eine konzentrierte Energiequelle entstehen keine Verbindungen, da die zur Bildung der Moleküle notwendigen freien Radikale nicht erzeugt werden können. Auch die Mischung der Gase wurde abgeändert und variiert. Solange die Elemente C, H, O und N in irgendeiner Form vorhanden sind, kann man organische Verbindungen synthetisieren. Man fand aber heraus, dass die Synthese von größeren Mengen an Aminosäuren nur mit den reduzierenden Gasen NH3 und CH4 erreicht wird. Wasserstoff muss dabei nicht vorhanden sein. Ersetzt man die energiereichen Gase durch ihre neutralen Analoge CO2 und N2 fällt die Ausbeute an Aminosäuren deutlich geringer aus. Auch das Vorhandensein von Sauerstoff wirkt sich negativ auf die Synthese von Aminosäuren aus. Außerdem wären Aminosäuren in Gegenwart von Sauerstoff über geologische Zeiträume hinweg nicht stabil gewesen.20
20 vgl. [3], S. 49-58; [2], S.90-116; [10] Evolution
| 5. Die Schwachpunkte und Kritik am Miller-Urey-Experiment |
Während die chemischen Befunde des Miller-Experiments nicht im Geringsten angezweifelt
werden, gibt es über die Details der simulierten Bedingungen jedoch abweichende Ansichten und
auch berechtigte Kritik am Miller-Urey-Experiment. 1966 stellte Philip H. Abelson, ein
amerikanischer Physiker, Chemiker und zeitweiliger Herausgeber der Fachzeitschrift Science, als
einer der Ersten die Annahmen hinter Millers Simulationsexperiment in Frage. Er erklärte, dass die
urzeitliche Atmosphäre keinesfalls reduzierend war und nicht aus H2, CH4, NH3 und H2O-Dampf
bestehen konnte. Da Wasserstoff zu leicht ist um durch die Gravitation der frühen Erde gehalten zu
werden, verflüchtigte er sich schnell in den Weltraum. Auch Methan und Ammoniak konnten nicht
lange bestehen, da diese Gase durch die UV-Einstrahlung der Sonne photochemisch zersetzt und
mit Spaltprodukten des Wassers zu CO2, CO und N2 oxidiert wurden. Ein weiteres Argument gegen
eine reduzierende Uratmosphäre beschreibt Abelson so: "Wenn es jemals große Mengen an
Methan in der Erdatmosphäre gegeben hat, sollte es dafür geologische Beweise geben.
Laboratoriumsversuche zeigen uns, wenn eine dichte, stark reduzierende Atmosphäre bestrahlt
wird, entstehen hydrophobe organische Moleküle, die von sinkendem Lehm aufgesogen werden.
Die ältesten Gesteine sollten daher eine ungewöhnlich große Menge an Kohlenstoff von
organischen Chemikalien enthalten. Das ist nicht der Fall."21
Tatsächlich belegen Sedimentgesteine
aus Grönland, dass es zumindest vor 3,8 Milliarden Jahren Kohlenstoffdioxid in der Atmosphäre
gegeben haben muss. Unter den von Abelson angenommen Bedingungen entstehen beim Miller-
Experiment aber lediglich kleine Mengen von Blausäure und der einfachsten Aminosäure Glycin
(vgl. 4.5). Ohne eine reduzierende Atmosphäre hätten sich also nicht genügend Verbindungen für
die weitere chemische Evolution im Urozean ansammeln können. Abelsons Kritik eröffnete eine
heftige Debatte um die Entstehung und Zusammensetzung der urzeitlichen Atmosphäre, welche bis
heute anhält.
Hinzukommt, dass ein Großteil der in der Atmosphäre synthetisierten Produkte durch UV-Strahlung
schnell wieder zerstört worden wären, bevor sie die Oberfläche der Erde überhaupt erreicht hätten.
Bei Berechnungen hat sich herausgestellt, dass die Konzentration an organischen Verbindungen in
den Urmeeren viel zu gering für eine direkte Bildung von Polymeren und komplizierten Strukturen
wäre. Einer der führenden Experten für chemische Evolution, Klaus Dose von der Johannes-
Gutenberg-Universität in Mainz meint dazu:
"Wir kommen aber zu dem Schluss, dass der Urozean große Mengen an Aminosäuren und anderen Arten von Molekülen enthalten haben könnte, die für das Leben wichtig sind; aber ihre Konzentration war zu gering, als dass dort präbiotische Systeme entstehen könnten."22
Deshalb glaubt man heute, dass das Leben nicht in den Meeren, sondern in Lagunen und Sümpfen entstand. Dort könnten sich auch höhere Konzentrationen an organischen Verbindungen angesammelt und weiterreagiert haben.23 Doch auch bei ausreichender Konzentration kann die Kondensation der Aminosäuren zu Proteinen nicht ohne weiteres in wässrigem Milieu ablaufen, da bei der Reaktion auch Wasser entsteht.
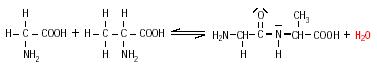
Das Gleichgewicht der Reaktion wäre in wässriger Umgebung daher zur Aufspaltung in die Edukte hin verschoben, sodass die Synthese der Peptide benachteiligt ist. Heute geht man deshalb davon aus, dass die Bildung von Proteinen und Nukleinsäuren katalysiert wurde. Dies könnte in Lehm und Ton an den Flächen von Mineralen und Kristallen abgelaufen sein. Sie enthalten mikroskopisch kleine Poren, in welchen Molekülanreicherungen entstehen konnten. Anorganische Moleküle wurden mit der Zeit durch Kohlenstoffverbindungen ersetzt, aus denen dann organische Makromoleküle, Membranen und schließlich die DNA und Zellen entstanden. Auch Stanley Miller ist sich inzwischen bewusst, dass die in seinem Simulationsexperiment entstandene Ursuppe allein nicht zur Entstehung von Leben führen konnte und räumt ein: "Den Ursprung des Lebens zu ergründen ist doch wesentlich komplizierter, als ich - und nicht nur ich allein - damals dachte."24
22 siehe [17]
23 vgl. [8]
24 vgl. [7], S.81
| 6. Die Bedeutung und Würdigung der Arbeit von Miller |
Es ist inzwischen über 50 Jahre her seit Stanley Miller seinen Versuch das erste Mal durchgeführt hat. Deshalb ist es auch nicht verwunderlich, dass einige Annahmen auf welchen das Experiment im Jahre 1952 beruhte in Frage gestellt werden. Grundsätzlich hat Miller mit Hilfe seines Simulationsexperimentes aber bewiesen, dass chemische Reaktionen, die unter bestimmten Bedingungen der frühen Erde unweigerlich abliefen, zu Produkten und Molekülen führen, die die Bausteine des Lebens darstellen. Die Möglichkeit der chemischen Evolution ist belegt, sodass die erstmals von Oparin und Haldane aufgestellte Hypothese allgemein anerkannt wird. Die Erkenntnisse des Miller-Experiments wurden zudem bestätigt, als man 1969 in Australien einen Meteoriten fand, der die gleichen Verbindungen und Aminosäuren abiotischen Ursprungs in den gleichen Verhältnissen enthielt, wie sie auch in Millers Experiment synthetisiert wurden. Daraus konnte man schließen, dass die simulierten Prozesse natürlich waren und tatsächlich auf Asteroiden, anderswo im Weltall und der urzeitlichen Erde abgelaufen sind.25
Aber sogar wenn man der Annahme einer reduzierenden Uratmosphäre oder dem ausreichenden
Vorhandensein organischer Verbindungen widerspricht, verdient Stanley Millers Arbeit volle
Anerkennung. Die Bedeutung wissenschaftlicher Beobachtungen und Experimente hängt nicht
zuletzt von ihrem spezifischen geschichtlichen Hintergrund ab und Stanley Miller öffnete mit seinem
Experiment neue Wege der empirischen Forschung zum Ursprung des Lebens.
25 vgl. [3], S.88-91
| 7. Versuche zur Synthese von Aminosäuren nach dem Vorbild des Miller-Experiments |
Das beschriebene Experiment habe ich mit den Möglichkeiten unseres Schullabors durchführen und nachvollziehen können. Dabei habe ich zwei Versuchsläufe durchgeführt, wobei der erste Versuch vom originalen Miller-Experiment abwich.
| 7.1 Der Versuchsaufbau |
Die unten skizzierte Apparatur (vgl. Abb. 10) habe ich aus Einzelteilen nach dem Modell des Miller- Experiments zusammengebaut. Dazu wurden ein 0,5-Liter 3-Halskolben und ein 1-Liter 4-Halskolben miteinander zu einer geschlossenen Anlage verbunden. Durch die beiden seitlichen Öffnungen des großen Kolbens wurden die Elektroden mit Gummistopfen eingebracht. Auch mittels Gummistopfen und einem wenige Zentimeter langen Stück Glasrohr wurde der große Kolben an der unteren Öffnung mit einem Dimroth-Kühler verbunden. Der Kühler wurde wiederum mit Hilfe zweier Gummistopfen und einem Glasrohrstück mit einem U-Rohr zusammengeschlossen. An dessen unterem Ende befand sich ein Einwegehahn, der zur Entnahme von Proben sein sollte. Das U-Rohr wurde über einen Vakuumschlauch mit Gummistopfen und einem Schliffübergang mit dem kleinen Kolben verbunden.
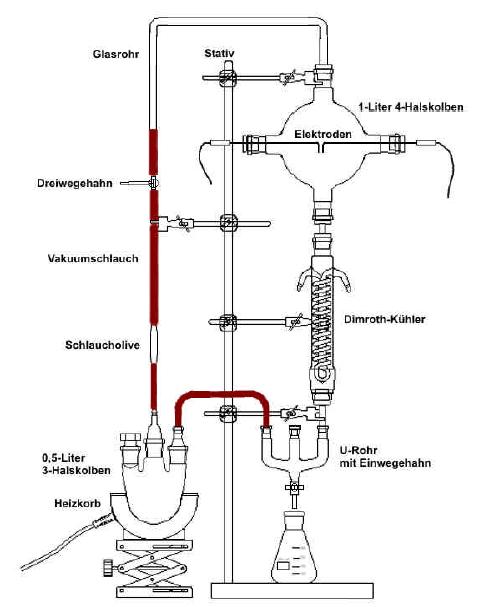
| 7.2 Der erste Versuchslauf |
| 7.2.1 Die Durchführung und Beobachtungen |
Zunächst wurden 200ml H2O in den kleinen Kolben gegeben. Dann konnte eine Vakuumpumpe an
den vorgesehen Hahn angeschlossen werden, um der Apparatur aus den bereits dargelegten
Gründen den Sauerstoff zu entziehen (vgl. 4.3). Danach wurden über den gleichen Hahn mit Hilfe
eines Luftballons die Gase H2, NH3 und CH4 im ungefähren Verhältnis von (H2) : (NH3) : (CH4) = 1:2:2
hinzu gegeben. Die Anteile und Menge der zugeführten Gase sind laut Dr. Miller sehr variabel,
sodass eine genaue Abmessung nicht notwendig ist.26
Anschließend wurde die Apparatur verschlossen und das Wasser zum Sieden gebracht. Nachdem sich der Wasserdampf in der Apparatur verteilt hatte, wurde schließlich die elektrische Entladung zwischen den Elektroden in Gang gesetzt. Nach wenigen Sekunden kam es zu einer Explosion, unter deren
Energie und Druckentwicklung die Stöpsel zur Verbindung des eingepassten Glasrohrs und der Elektroden aus dem großen Kolben heraus gedrückt wurden (vgl. Anhang S.IV). Nach einem Tag hatte sich das Wasser im kleinen Kolben
allerdings hellbraun verfärbt, ein Indiz dafür, dass organische Verbindungen entstanden waren (vgl. Abb.11).
26 vgl. [19]